近日,上海交通大学张万斌课题组成功开发了一例Pd/Cu双手性金属协同催化外消旋二级苄基醋酸酯的不对称苄基取代反应,解决了不对称苄基取代反应中二级苄基底物容易发生β-H消除和苄位手性中心立体控制难的问题,实现了相邻苄位-季碳手性中心的不对称构建。在相同起始原料与反应条件下,仅仅通过改变两个手性金属催化剂构型组合方式,首次实现了立体发散性的苄基取代反应。实验与理论计算研究揭示了反应的动态动力学不对称转化过程与立体选择性来源。
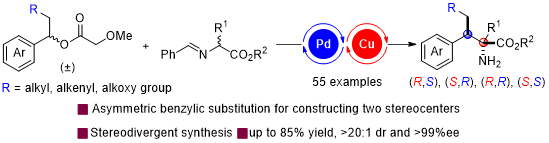
含苄位手性中心的骨架广泛存在于天然产物以及生物活性分子中。因此,开发一种简单又高效的方法实现苄位手性中心的构建具有重要的意义,也引起了有机合成化学家的极大研究兴趣。过渡金属催化的二级苄基底物的不对称苄基取代反应是构建苄位手性中心最为直接与有效的方法之一。在过渡金属催化的不对称苄基取代反应中,η3-苄基金属中间体的形成涉及去芳构化过程,需要克服较高的反应能垒,导致该反应发展严重滞后。更具有挑战性的是,二级苄基底物的不对苄基取代反应还面临着β-H消除副反应和手性控制难等问题,目前还没有行之有效的解决方法。
上海交通大学张万斌课题组长期深耕于双金属催化体系的开发(J. Am. Chem. Soc. 2016, 138, 11093; J. Am. Chem. Soc. 2017, 139, 9819; J. Am. Chem. Soc. 2018, 140, 2080; J. Am. Chem. Soc. 2020, 142, 8097; J. Am. Chem. Soc. 2021,143, 12622; Angew. Chem. Int. Ed. 2021,60, 24941; CCS Chem. 2021, 4, 1720; Angew. Chem. Int. Ed. 2023, 62, e202218146; Angew. Chem. Int. Ed. 2023, 62, e202313838),成功应用于不对称烯丙基取代反应与联烯取代反应中,解决了连续手性中心与非连续手性中心立体控制难的痛点。近来,双手性金属协同催化在调控反应活性与实现手性中心精准构建方面提供了有效的策略(Angew. Chem. Int. Ed. 2022, 61, e202210086)。在此,作者通过对金属与手性配体的匹配性与兼容性的精准调控,开发了一个Pd/Cu双手性金属协同催化体系,率先实现了立体发散性苄基取代反应,成功克服了外消旋二级苄基底物的β-H消除与苄位手性中心立体控制难的问题。
作者首先选择了外消旋的1-(2-萘基)乙基碳酸甲酯1a与醛亚胺甲酯2a为模板底物对反应的条件进行了筛选(图1a),实验发现,以轴手性的双膦配体(S)-MeO-BIPHEP作为金属钯盐的配体,二茂铁噁唑啉配体L1作为金属铜盐的手性配体,碳酸钾为碱,THF为溶剂,在50 °C下反应24 h,可以以34%产率,11:1的dr值与99% ee值得到苄基取代的目标产物,但同时伴随着34%β-H消除的副产物生成。当金属钯盐的抗衡阳离子使用非配位型的BF4负离子时,可以将目标产物产率提高至84%,同时目标产物的立体选择性基本保持不变,且β-H消除的副产物基本得到了抑制(图1b),说明非配位型的抗衡阴离子对调控反应选择性也起到了至关重要的作用。进一步优化发现,当以2-甲氧基乙酸根作为苄基底物的离去基团时,反应可以以82%产率,>20:1 dr值与>99% ee值得到目标产物(图1c)。
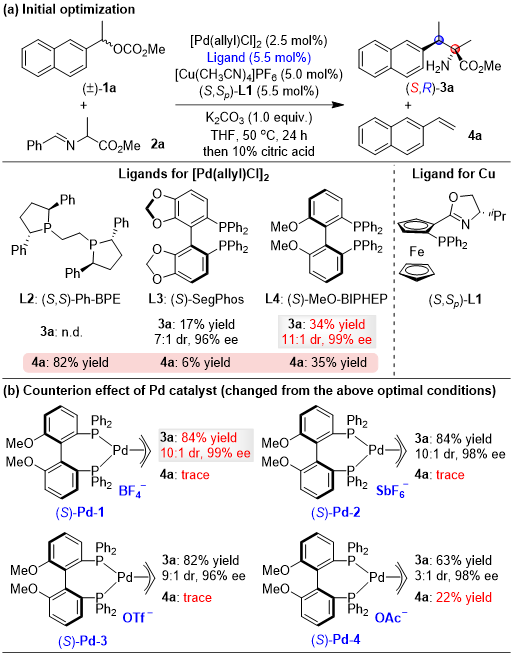
图1. Pd/Cu双金属催化体系反应条件的筛选
在此条件下,从相同起始原料出发,作者仅仅通过改变手性Pd催化剂与手性铜催化剂构型的组合方式,就可以方便的实现目标产物所有四个立体异构体的精准合成,即产物的立体发散性合成(图2)。
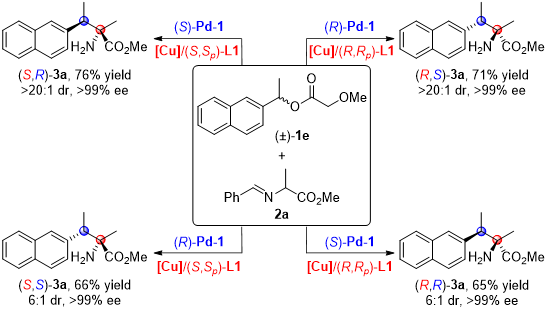
图2. 产物的立体发散性合成
在最优条件下,作者首先研究了外消旋二级苄基醋酸酯的底物范围,发现萘环上含有供电子基团与吸电子基团的底物都可以兼容该反应体系,以中等至优秀的产率和优异的dr值与ee值给出相应的目标产物(3b-3f)。同时,含有多环芳烃或者杂环芳烃的底物,如蒽、菲、苯并噻吩、吲哚、喹啉、喹喔啉和苯并吡唑均可参与反应,以37-83%的产率和高的对映与非对映选择性得到相应的目标产物(3g-3n)。值得注意的是,作者对于单环芳烃的反应活性进行了研究,并且发现噻吩、吡咯、噻唑和噁唑均能以中等的收率和优秀的对映选择性获得产物(3o-3s)。而对于简单的苯环类底物,在该Pd/Cu体系下只能以35%的产率获得外消旋的产物(3t)。而对于苄位含有不同烷基取代的1-(2-萘基)烷基醋酸酯底物也能顺利地参与反应,以中等的产率和高的对映与非对映选择性获得产物(3u-3y)。另外,部分由药物分子和天然产物衍生而来的二级苄基酯底物也能兼容该反应体系(3z-3aaa)。
对于亲核试剂的范围进行考察,发现一系列从天然和非天然氨基酸中衍生而来的醛亚胺甲酯均可以顺利地参与反应,以中等到优异的产率和高的对映与非对映选择性给出相应的苄基取代产物(3ab-3an)。值得注意的是,醛亚胺酰胺2d也能与此体系兼容,并以73%的收率,>20:1的dr值和98%的ee值给出产物3ad。其中,含有不同官能团取代的亲核试剂,如硫醚基、烯基、炔基、酯基与烷氧基等(3ai-3an),都可以很好的兼容该反应体系,以中等以上产率与高的立体选择性获得相应的目标产物。此外,以环状酮亚胺甲酯作为亲核试剂,反应也能以72%产率,11:1的dr值与>99% ee值得到产物(3ao)。
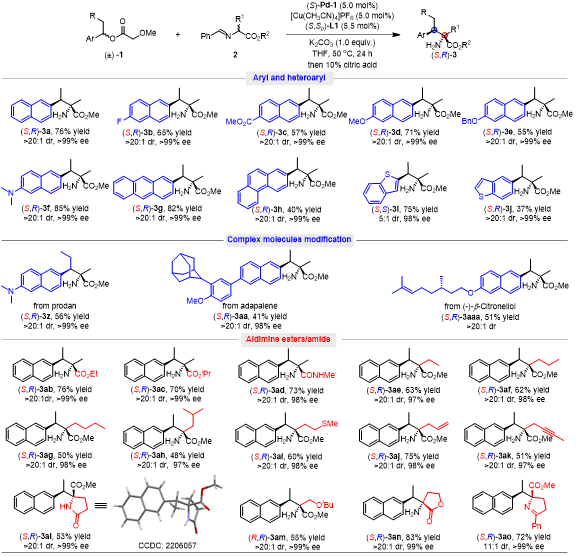
图3. 底物范围
为了检验该方法的实用性,作者随后将该反应放大至克级规模,发现标准反应仍然能以73%收率得到目标产物(S,R)-3a且对映和非对映选择性均保持不变(图4)。此外,该目标产物也可以进行一系列不同的官能团转化,得到不同类型的骨架分子。例如,产物中的酯基通过LiAlH4的还原可以转化为β-氨基醇(5a),后者在Boc2O和DMAP的作用下可以进一步地转化为噁唑烷酮(6a);产物中的氨基可以与氨基酸或者羧酸进行缩合,转化二肽或者酰胺类化合物;也可以进行环化反应得到硫代乙内酰胺与四氢异喹啉,且产物的对映与非对映选择性基本维持不变(图4)。
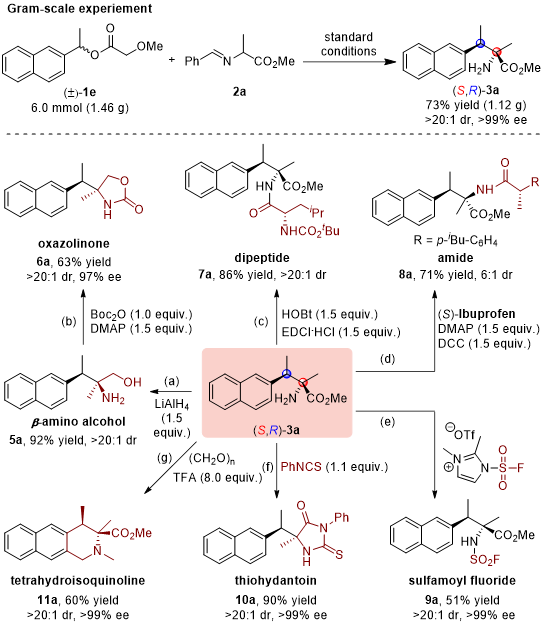
图4. 克级反应与产物的衍生
随后,为了深入理解该反应的机理,作者进行了一系列动力学实验研究。研究发现,光学纯的(R)-1e,(S)-1e和外消旋的(rac)-1e三者都可以顺利参与反应,并且最终均能以良好的收率和立体选择性得到相同产物(S,R)-3a,但(R)-1e的反应速率略快于(S)-1e;此外,光学纯的(R)-1e与(S)-1e在反应过程中,其回收的苄基底物的对映选择性基本保持不变。这些现象表明该反应经历了一个动态动力学不对称转化(DyKAT)过程。
为了进一步了解该反应的机理,作者随后又对整个反应的过程进行了理论计算的研究(图5)。在之前的文献报道中,钯催化剂与苄基底物的氧化加成形成η3-苄基钯中间体可能存在两种可能的路径,一种是类似Tsuji-Trost反应类型(Pathway A),另一种是类似于SN2取代反应(Pathway B)。DFT计算表明,该反应通过Pathway A形成η3-苄基钯中间体是更为可行的;且η3-苄基钯中间体Int1-1和Int1-3之间的转化可以通过与体系中零价钯的作用来实现互相转化(TS2),这进一步揭示了该反应经历了一个动态动力学不对称转化(DyKAT)过程。
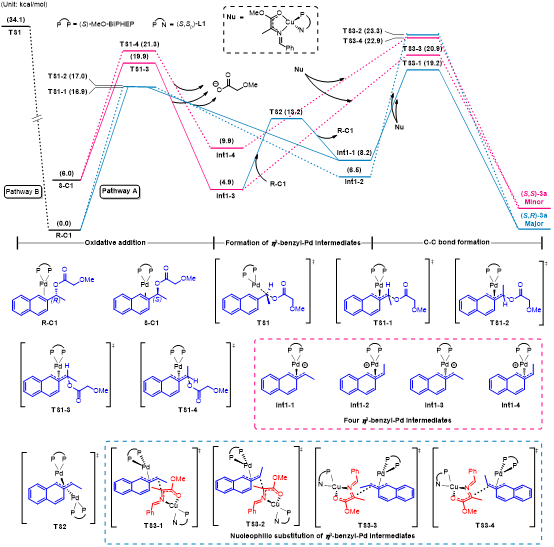
图5. Pd/Cu双金属催化的不对称苄基取代DFT计算结果
综上所述,上海交通大学张万斌课题组成功报道了一例Pd/Cu双手性金属协同催化的不对称苄基取代反应。通过协调双手性金属催化剂之间的匹配性,成功克服了外消旋二级苄基底物容易β-H消除与立体控制难的问题,以高的产率,高的非对映和对映选择性构建了一系列含有苄位手性中心与邻位季碳手性中心的α-氨基酸,首次实现了立体发散性的苄基取代反应。动力学实验与DFT计算表明了该Pd/Cu双手性金属协同催化外消旋二级苄基底物的不对称苄基取代反应经历了动态动力学不对称转化过程(DyKAT)。该策略为新型不对称苄基取代反应的开发提供了新思路。
此项研究得到了国家自然科学基金和上海市教委的资助。该工作以research article 的形式发表在CCS Chemistry,已在官网“Just Published”栏目上线。
文章链接:https://www.chinesechemsoc.org/doi/suppl/10.31635/ccschem.024.202303749



